酸素濃淡電池とは、酸素濃度の差によって発生する起電力を利用した電池のことであり、金属腐食原因の一つになる。淡水中での鉄のさびこぶ状の腐食や通気性の良い土壌と良くない土壌との界面部での腐食などが典型的な例である。
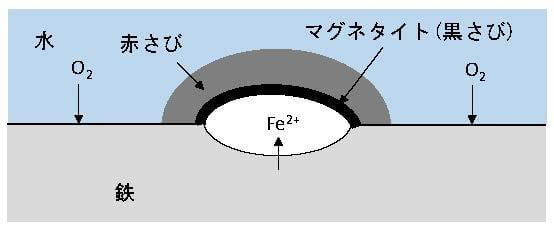
図1にさびこぶの成長メカニズムを示す。さびこぶ下をアノード、さびこぶ周囲をカソードとするマクロセル腐食である。さびこぶ内のピット部は空隙があり、その周りには黒さびが形成され、さらに周囲は赤さびで覆われている。これは酸素濃淡電池の作用を示唆する1)。さびこぶ内は外部とさび層で隔離されているので酸素不足におちいっている。
鋼の酸素濃淡電池腐食の実験室的なモデルは図2に示される2)。含酸素および脱酸素の同一組成溶液中に同一表面積の2個の鉄試片を浸漬し、酸素を吹込んだ方は陰極室となり、一方脱酸素した室は陽極室となる。
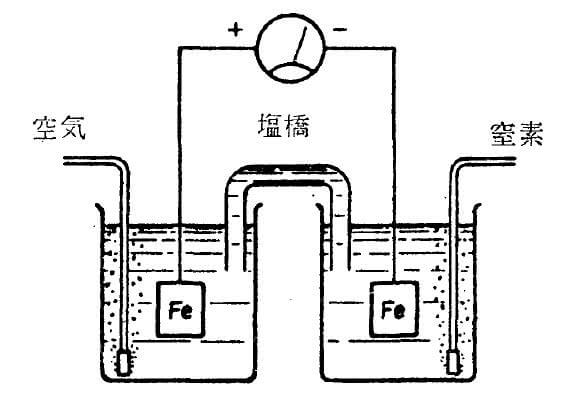
酸素濃淡電池による腐食反応では、含酸素極がカソード、脱酸素極がアノードになり、マイクロ電流が流れることによって腐食反応が進む。酸素濃淡電池における典型的な反応を次に示す2)。
\(\begin{align}
& \rm O_2 + 2H_2O + 4e^- \rightarrow 4OH^- \tag{1} \\
& Fe \rightarrow Fe^{2+} + 2e^- \tag{2}
\end{align}\)
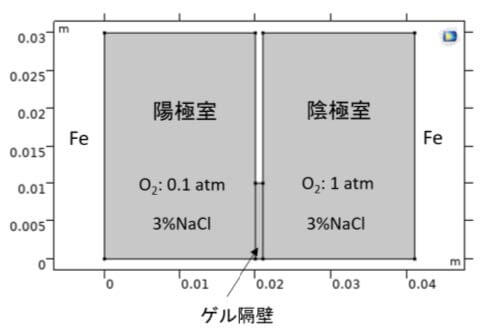
現在では酸素濃淡電池をいくつかの型に分けて論議しているが、ここでは、文献3)の酸素濃淡局部電池の腐食理論に従って、鉄のアノード溶解反応分極曲線は陰極室と陽極室の両溶液中で同じであると扱う。計算モデル3)を図3に示す。
鉄のアノード溶解反応と酸素還元反応をターフェル式として、平衡電位(\(E_{eq}\))、交換電流密度(\(i_0\))、ターフェル勾配 (A)はそれぞれ、
\(\begin{align}
& \textbf{鉄のアノード溶解反応:} \\
& E_{eq}({\rm V {\it vs.}SHE})=-0.44 \\
& i_0(\rm A/m^2)=0.039 \\
& \rm A(V/decade)=0.042
\end{align}\)
\(\begin{align}
& \textbf{酸素還元反応:} \\
& E_{eq}({\rm V {\it vs.}SHE})=1.229−0.0592×{\rm pH} \\
& i_0(\rm A/m^2)=1×10^{−8} \\
& \rm A(V/decade)=−0.13
\end{align}\)
とした4)。また、H2Oの解離反応を連成して計算した。
\(\begin{align}
\rm H_2O \rightarrow OH^-+H^+ \tag{3}
\end{align}\)
式(3)の反応の平衡定数とKfはイオン濃度の単位をmol/m3で表してそれぞれ、
\(\begin{align}
& K_{eq}=1.8×10^{-13} \\
& K_f=8.52×10^{-12}(1/\sec)
\end{align}\)
である3)。
本書では、酸素濃淡電池の計算手法を示す2次元モデル(図3)および、2章以後に図4と図5の解析結果を作成する手順を示した。計算をNaCl溶液の濃度として3%(0.51M)水溶液で行った。初期pHは7であり、溶液中はNa+、Cl–、H+、OH–、Fe2+、O2、H2Oの拡散泳動をNernst-Planckの式(4)で計算して連成した。
\(\begin{align}
\frac{\partial c_i}{\partial t} + \nabla・(-D_i\nabla c_i-z_iu_{m,i}Fc_i\nabla\phi_l+c_i{\bf u})=R_i \tag{4}
\end{align}\)
ここで、\(c_i\)、\(D_i\)はそれぞれの化学種の濃度と拡散係数、\(z_i\)はイオンの価数、\(m_i\)は移動度、\(\phi_l\)は溶液の電位、\(\bf u\)は溶液の流速、\(R_i\)は反応速度である。
酸素還元反応は、電極表面の酸素濃度に影響を受けるので、バルク濃度と電極表面での濃度比に比例するという(5)の条件を設定した5)。
\(\begin{align}
i_{O_\text{2_red}}\propto \rm cO_2\_ s/cO_2\_0 \tag{5}
\end{align}\)
ここで、\(i_{O_\text{2_red}}\)は反応電流密度すなわち反応速度、\(\rm cO_2\_ s\)は電極表面の酸素濃度、\(cO_2\_0\)はバルク酸素濃度である。
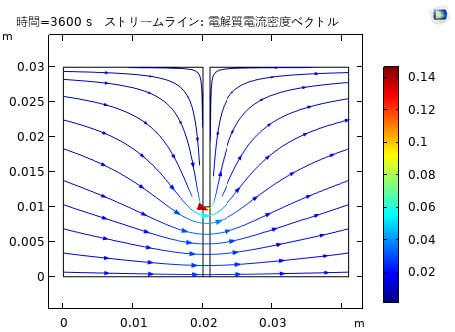
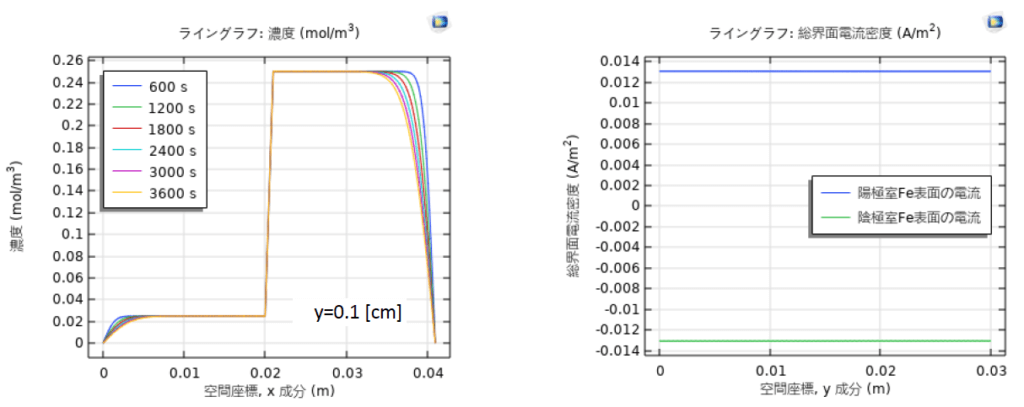
図4は腐食が発生した1時間後の電解質電流密度分布である。陰極室と陽極室における酸素分布とFe表面の電流密度は図5に示している。両溶液中のFe表面電流は正負の値で分けることで、酸化反応と還元反応をバランスしていることを示唆する。
参考文献
1) 藤井哲雄,「金属の腐食事例と対策」,工業調査会,p.61 (2002)
2) E. Schaschl, G. A. Marsh, 濃淡電池と水溶液腐食, 防蝕技術, 10 (4), p. 166-174 (1961).
3) 腐食防食協会編, 腐食防食ハンドブックCD-ROM版, 丸善, 2005.
4) 腐食防食協会編,「金属の腐食防食Q&A電気化学入門編」,丸善,p.59 (2002).
5) 山本正弘,材料と環境, 71, 97-100 (2022).
*該当のCOMSOLモデルファイルと手順書をご要望のお客様は下記よりダウンロードいただけます。